No dia 18 de junho (dia do Químico) eu criei este blog com o objetivo de ajudar meus alunos nos conteúdos e já ultrapassamos as 1000 visualizações!
Um mol de obrigado a todos vocês.
Blog mantido com o objetivo de auxiliar estudantes do ensino médio na aprendizagem de química. Conteúdos químicos e variedades. Este Blog está em construção.
quarta-feira, 29 de junho de 2016
ALGUMAS CONFUSÕES DAS SOLUÇÕES.
SOLUÇÕES E DISPERSÕES.
Imagine uma situação. Você vai ao mercado comprar água
sanitária e se depara com a marca X que custa R$5 reais um litro, e a marca Y
que custa R$ 4 um litro. O princípio
ativo da água sanitária é o hipoclorito de sódio. Na marca X a concentração
desse sal é 2,5% e na marca Y a concentração é 2%. Qual deles é mais vantajoso
ser comprado?
Agora você vai comprar refrigerante, e na informação
nutricional diz que para cada 200 mL desse refrigerante têm 21 g de carboidrato
(açúcar) para cada 200 mL. Quanto açúcar você terá consumido depois de beber 2
L desse refrigerante?
Esses dois pepinos eu vou deixar pra vocês descascarem.
Vamos primeiro entender o que é solução? Solução é por
definição uma mistura homogênea, onde as partículas dissolvidas têm um tamanho
menor do que 1 nanômetro, isto é, 1 metro dividido por 1 bilhão. Tanto as soluções quanto os coloides
e as suspensões são chamadas de dispersões. Elas são formadas por um
dispergente, o material que mantem dispersas as partículas que estão misturadas
nela. Já o disperso é o material que está misturado ao dispergente. Exemplos.
Dispersão
|
Dispergente
|
Disperso
|
Água salgada
|
Água
|
Sal
|
Nuvem
|
Ar
|
Gotículas
de água
|
Leite
de magnésia
|
Água
|
Hidróxido
de magnésio.
|
As soluções são formadas por um solvente, que é a
substância que dissolve, e um soluto, que é a substância é dissolvida. O soro
fisiológico, por exemplo, tem uma concentração de 0,9% de NaCl. Então quem é o
solvente e quem é o soluto? O solvente é nesse caso a água, e o soluto é o
NaCl. Eu não vou ficar me demorando aqui para explicar como se calculam as
concentrações das soluções. Os vídeos, acredito que fazem isso melhor.
Mas vamos aqui tentar resolver outras confusões que
ocorrem a respeito das soluções.
1ª. Uma garrafa de 2 L de refrigerante de cola têm uma
concentração de 1 g/L de ácido
fosfórico. Se eu dividir essa garrafa em 8 copos de 200 mL, qual será a
concentração do ácido em cada copo?
A concentração será a mesma. Por quê? Por que quando
pegamos um volume de uma solução e dividímos ele em vários recipientes, estamos
colocando em cada recipiente a mesma proporção entre soluto e solução,
concentração será mesma da concentração existente na embalagem original.
2ª. Joãozinho colocou em uma panela, um litro de água e
uma colher de sal, ele provou a água e colocou a panela no fogo até restar
apenas 0,5 L de água dentro dessa panela. Se Joãozinho provar a água, ela
estará mais salgada, igual ou menos salgada do que antes de evaporar?
Ela estará mais salgada, ou seja, a concentração de sal
nessa água estará maior do que no início. Por que isso acontece? De novo, a
concentração é a razão da quantidade de soluto, pela quantidade de solução.
Quando a água da panela evaporou, a quantidade de sal permaneceu a mesma,
restando a mesma quantidade de sal para uma menor quantidade de água.
3ª Imagine que nosso herói da questão acima pegou essa
mesma panela e colocou mais 1,5 L de água dentro. Agora a água estará mais
salgada ou menos do que no início?
Ela estará menos
salgada. Por quê? Por que quando ele colocou mais 1,5 L de água na panela o
volume passou a ser 2 L, porém a quantidade de sal não aumentou, continuou a
mesma da situação inicial. Isso quer dizer que existe muito mais água para a
mesma quantidade de sal, então a solução ficou menos concentrada.
terça-feira, 28 de junho de 2016
E SE O OXIGÊNIO DO MUNDO ACABASSE POR 5 SEGUNDOS?
Há um bom tempo eu vi uma postagem no Não Intedo com imagens bem explicativas sobre o que aconteceria se todo o oxigênio do mundo acabasse por 5 segundos. O oxigênio é o elemento químico mais abundante na crosta terrestre, 49,4% e ele não existe apenas na forma de gás. Está ligado com outros elementos formando uma enormidade de substâncias. A água, a areia, o concreto, o vidro, e muitas outras substâncias são constituídas por átomos de oxigênio, inclusive as proteínas e gorduras do nosso corpo.
segunda-feira, 27 de junho de 2016
POR QUE NÃO DEVEMOS COMETER FALÁCIAS, OU POR QUE DEVEMOS NOS POLICIAR PARA NÃO COMETÊ-LAS
Eu não lembro qual aluno que me perguntou semana passada como eu seria se desse aula de filosofia. Na verdade eu já pensei nisso.
Na construção de um argumento científico, ou mesmo em um debate sobre algum assunto importante ou mesmo em uma conversa informal precisamos tomar cuidado para não cometermos uma falácia. Falácias são argumentos não verdadeiros, lógicos ou não, que são usados para desvirtuar um debate ou então induzir uma interpretação ou conclusão ao erro. O termo falácia vem do finado Latin e significa mentir. Existem muitos tipos de falácias e muitas delas têm apenas o "inocente objetivo de desqualificar uma tese", outras muito pior, têm o objetivo de desqualificar quem propõem essa argumentação.
Uma boa argumentação é importante para a defesa de uma ideia, ou então para derrubá-la de modo coerente e intelectualmente honesto. Também é importante para a defesa de um trabalho do ensino médio ou então para a elaboração de um trabalho acadêmico, ou para não passar vergonha naquela treta do Facebook. Pensando nisso, para ajudar meus alunos nisso, eu fiz uma busca sobre esse tema para postar o material aqui no meu Blog. Para não ficar me repetindo vou apenas postar os links abaixo, para que vocês possam 'beber' direto da fonte.
NÃO COMETERÁS ESTAS 24 FALÁCIAS LÓGICAS.
NÃO COMETERÁS ESTAS 24 FALÁCIAS LÓGICAS.
Já vou adiantando aqui duas falácias muito usadas por aí.
Argumento ad homnin, que tem o objetivo de desqualificar o argumentador, quando não se consegue desqualificar o argumentador.
Falácia do espantalho, ou boneco de palha. Quando para desqualificar um argumento se distorce ele para ficar mais fácil de atacar.
domingo, 26 de junho de 2016
Propriedades coligativas das soluções.
PROPRIEDADES COLIGATIVAS DAS SOLUÇÕES.
TONOSCOPIA OU TONOMETRIA.
As substâncias puras que estão em estado
líquido à temperatura ambiente, possuem um determinado ponto de ebulição, e
esse ponto de ebulição é relacionado à sua pressão de vapor. Quanto maior a pressão
de vapor, menor o ponto de ebulição. A pressão de vapor é a pressão que o vapor
de um líquido exerce em um sistema fechado. Acontece que quando se adiciona um
soluto não volátil (que não evapora facilmente), a um líquido puro, o ponto de
ebulição de desse líquido aumenta devido à redução da sua pressão de vapor. Essa
variação da pressão de vapor é chamado de efeito tonoscópio.
O que isso quer dizer em termos práticos?
Quer dizer que quanto mais sal você adicionar na água maior será o seu ponto de
ebulição, ou no caso de açúcar também. Essa variação é calculada pela equação
da Lei de Ranoult.
Psolução = xsolvente .
Psolvente puro em que xsolvente é a fração em quantidade
de matéria. (mol de soluto/(mol de solvente + mol de soluto)).
Veja alguns exemplos de líquidos puros e suas
pressões de vapor.
Líquido
|
Pressão de vapor em mmHg
|
Ponto de ebulição em °C e pressão de 1 atm.
|
Água
|
17,5
|
100
|
Álcool
|
44
|
78,37
|
Acetona
|
185
|
56
|
Éter dimetílico
|
442
|
-24
|
Mercúrio
|
0,0012
|
357
|
Benzeno
|
75
|
80,1
|
EBULIOSCOPIA E CRIOSCOPIA.
Aqui no Rio Grande do Sul temos um inverno bastante
rigoroso se comparado aos demais estados brasileiros. Durante o inverno, alguns
dias são tão frios que a temperatura fica abaixo de 0°C, fazendo com que a água
dos radiadores dos carros congele se não tiver um anticongelante adicionado.
Também é visto que a geada queima algumas plantas e outras não.
Então?
A água tem seu ponto de fusão em 0°C, porém se
adicionarmos sal de cozinha, ou outro soluto a ela, seu ponto de fusão diminui
em relação à quantidade de partículas de solvente adicionado. Então que isso
quer dizer com crioscopia? Crisocopia é a mediada da variação de temperatura de
um solvente com a adição de um soluto.
Tá mas e aí? Por que algumas plantas não se
queimam com a geada?
Por
que a sua seiva tem uma concentração de açúcares em quantidade suficiente para
que não se forme cristais de gelo no seu interior.
Mas tem diferença entre os solutos?
Sim! Solutos moleculares como a glicose não
se dissociam em água. Assim se adicionarmos um mol de glicose em um litro de
água a concentração de partículas desse soluto será de 1 mol por litro. Mas se
adicionarmos um composto iônico, que se dissocia em água, teremos, por exemplo,
com a adição de 1 mol de NaCl em um litro de água, 1 mol de Na+ e 1
mol de Cl-.
O que isso quer dizer?
Quer dizer que se adicionarmos 1 mol de
glicose em um litro de águam ela se congelará em uma temperatura maior do que
se fosse adicionado um mol de NaCl, e esse, numa temperatura maior do que se
tivesse adicionado 1 mol de MgCL2.
E a Ebulioscopia?
Ebulioscopia é o aumento da temperatura de
ebulição de um líquido em relação à adição de um soluto não volátil.
Tá e daí?
Daí que se você adicionar sal à água, ela ira
ferver a uma temperatura maior do que 100°C, e você cozinhará as batas mais rapidamente
na água salgada. Um queimadura com água doce é pior que uma queimadura com água
pura. E quanto maior a concentração de partículas de soluto, maior será o
aumento dessa temperatura. Essa variação de temperatura de uma solução pela
adição de um soluto segue a mesma tendência da crioscopia.
Mesmo com as temperaturas negativas a água do mar não congela facilmente devido à sua salinidade. Créditos da imagem.
Mesmo com as temperaturas negativas a água do mar não congela facilmente devido à sua salinidade. Créditos da imagem.
OSMOSE E PRESSÃO OSMÓTICA.
Osmose é a passagem de um solvente de um meio
menos concentrado para um meio mais concentrado através de uma membrana
semipermeável com o objetivo de igualar as concentrações das soluções dos dois lados.
O que isso quer dizer em termos práticos?
Um exemplo. Se você pegar uma fruta e colocar
ela mergulhada em uma salmoura bem forte ela irá murchar.
Como assim?
A concentração de sais na salmoura é muito
maior do que na fruta, então a água que está dentro da fruta irá passar para a
salmoura para equilibrar as concentrações de sais nos dois meios. A tendência é
o fluxo de água seguir até as concentrações se igualarem. Como as paredes das
células dessa fruta são semipermeáveis, passa por ela somente a água e os sais
ficam presos.
A quando duas soluções de concentrações
diferentes estão separadas por uma membrana semipermeável, a solução mais
concentrada é hipertônica, a menos concentrada é a hipotônica. Quando as duas
concentrações são iguais elas são isotônicas.
Isotônicas? Tipo o Gatorade?
Quase isso. O Gatorade é uma bebida isotônica
porque a concentração de sais nele é a mesma existente no organismo humano.
E a pressão osmótica?
É a pressão necessária para evitar que o
solvente passe do lado menos concentrado para o lado mais concentrado.
Mas e o que aconteceria se aplicar uma
pressão maior do que a necessária?
Aí nós dessalinizamos a água....
Hã?
A dessalinização da água realizada onde a
água doce é escassa, consiste num processo de osmose reversa. Uma pressão muito forte é aplicada sobre a água
salgada para que a água pura atravesse a membrana semipermeável e possa ser
consumida. Esse processo de osmose reversa pode ser usado para outros tipos de
soluções.
Agradecimentos à Professora Paulinha de Biologia que me ajudou com a osmose que também é assunto de Biologia.
Agradecimentos à Professora Paulinha de Biologia que me ajudou com a osmose que também é assunto de Biologia.
Esta postagem poderá passar por atualizações durante a semana.
Referências
ANTUNES, Murilo Tissoni. SER PROTAGONISTA. QUÍMICA 2. São Paulo. Edições SM Ltda. 2013.
sexta-feira, 24 de junho de 2016
#Garrancho 3 - Petróleo, Plástico e Star Wars.
Este vídeo fala sobre o plástico as vantagens e os problemas de seus usos. Uma vantagem que é a sua durabilidade, também se torna um problema pois quando abandonado na natureza ele demora centenas de anos para se decompor. O vídeo é do canal Blá blá Logia, um canal que fala sobre ciência.
Outros materiais:
Latas de conserva: 100 anosMadeira pintada: 13 anos
Pano: de 6 meses a 1 ano
Fralda descartável: 600 anos
Linha de Nylon (de pesca): 650 anos
3 meses:
A lignina, substância que dá rigidez às células vegetais, é um dos componentes mais importantes do papel. Ela não se decompõe facilmente,
pois suas moléculas são maiores do que as bactérias que as destroem. Num
lugar úmido, o papel leva três meses para sumir e ainda mais do que
isso em local seco. Além disso, um papel absorvente dura vários meses.
Jornais podem permanecer intactos por décadas.
6 meses:
A deterioração de um fósforo de madeira começa com a invasão da lignina (seu principal ingrediente) por hordas de fungos e insetos
xilófagos, os que comem madeira. O processo é lento e, em um ambiente
úmido, um fósforo não se destrói até que se passe cerca de seis meses.
6 a 12 meses:
Os microorganismos, insetos e outros seres invertebrados geralmentetransformam a matéria orgânica de forma eficaz. No entanto, o miolo de
uma maçã, que se decompõe em uns seis meses em clima quente, pode
conservar-se por um ano num lugar mais ameno. Isso porque o orvalho (e a
neve nos países frios) dificulta a proliferação dos micróbios e
diminui sua capacidade devoradora.
1 a 2 anos:
Um cigarro pode demorar de um a dois anos para se decompor, tempo emque as bactérias e fungos digerem o acetato de celulose existente no
filtro. Jogar um cigarro sem filtro no campo é nocivo, uma vez que o
tabaco e a celulose levam quatro meses para sumir. Contudo, se jogado no
asfalto, o tempo de vida da bituca é ainda maior.
5 anos:
Um chiclete jogado no chão começa a ser destruído pela luz e pelooxigênio do ar, que o fazem perder a elasticidade e a viscosidade. Como a
goma contém resinas naturais e artificiais, além de açúcar e outros
ingredientes, o processo pode durar até cinco anos. A pulverização do
chiclete é mais rápida se ele grudar no sapato de algum distraído.
10 anos:
Os metais, em princípio, não são biodegradáveis. Uma lata de aço sedesintegra em uns dez anos, convertendo-se em óxido de ferro. Em dois
verões chuvosos, o oxigênio da água começa a oxidar as latas feitas de
aço recoberto de estanho e verniz. Já uma lata de alumínio dificilmente será corroída devido à sua película protetora composta por óxido de alúminio. E boa parte dos refrigerantes é vendida em latas de alumínio.
mais de 100 anos:
As boas qualidades do plástico são sua durabilidade e resistência àumidade e também a diversos produtos químicos como ácidos bases, e solventes. Essa resistência química o torna também resistente à química do solo. Como suas moléculas são muito grandes, é muito difícil para os microrganismos consumi-lo. Como esse
material existe há apenas um século, não é possível determinar seu grau
de biodegradação, mas estima-se que uma garrafa de plástico demoraria
centenas de anos para desaparecer.
4000 anos:
O vidro não se biodegradará jamais. Sua resistência é tamanha, quearqueólogos encontraram utensílios de vidro do ano de 2000 a.C. Por ser
composto de areia, sódio, cal e vários aditivos, os microorganismos não
conseguem comê-lo. Um recipiente de vidro demoraria 4.000 anos para se
desintegrar pela erosão e ação de agentes químicos.
Fonte: www.ecolegal.com.br via UNIFESP. Universidade Federal de São Paulo
Química - Aula 6: Química Orgânica - Hidrocarbonetos Ramificados
Peregrinando pelo Oráculo Sagrado, encontrei esse vídeo que explica até muito melhor do que eu.
quinta-feira, 23 de junho de 2016
Para que serve o cálculo estequiométrico?
Estequiometria 2.
Como foi dito na postagem anterior O Cálculo estequiométrico é o
cálculo que permite relacionar quantidades de reagentes e produtos, que
participam de uma reação química com o auxílio das equações químicas
correspondentes. Na indústria ou em um laboratório precisamos usar quantidades
certas de reagentes para que não sobrem nem faltem. É preciso calcular qual a
massa de produto será produzido em uma reação sabendo a massa de reagentes
usados.
Mas e aí
professor? O que são reagentes e o que são produtos de uma reação química?
Tá bom. Deixei
passar esse detalhe na primeira postagem, e pra não deixar vocês na mão eu
voltei e já vou explicar.
Imaginem que
vocês estão em uma indústria química e precisam produzir ácido clorídrico HCl. Esse
ácido é vendido com o nome de ácido muriático, ele é usado para remover cimento
do piso por exemplo. Ele é produzido misturando gás cloro (Cl2) com
gás hidrogênio (H2). A equação química dessa reação é a seguinte.
H2 +Cl2
→ 2HCl
Quem são os
reagentes? Os reagentes são as substâncias que estão à esquerda da seta. São as
substâncias que reagirão para produzir o que desejamos nesse caso os reagentes
são o gás cloro e o gás hidrogênio. Os produtos por sua vez são o resultado da reação,
nesse caso o produto é HCl.
Vamos calcular
qual massa de gás cloro é necessária para produzir 1000g de ácido.
Aí que entra a
massa molar. A massa molar do gás cloro é, (olhem na tabela periódica a massa
atômica do elemento cloro) 35,45, então como o Cl2 tem 2 átomos de
cloro, sua massa molar é 70,9 g/mol. Vamos calcular também a massa molar do
HCl. De novo massa atômica do elemento cloro, Cl é 35,45 e a massa atômica do
elemento hidrogênio é 1. Como o HCl é formado por 1 átomo de hidrogênio e 1
átomo de cloro, sua massa atômica é 35,45 + 1 = 36,45 g/mol.
Agora vamos
calcular.
Como foi
demonstrado na equação acima, 1 molécula de Cl2 produz duas moléculas
de HCl, pode-se deduzir então que 1 mol de Cl2 produza 2 mols de
HCl. Então sabendo disso vamos para a nossa boa e velha regra de 3. Como
sabemos a massas do HCl que é produzido, precisamos encontrar apenas a massa de
gás cloro.
H2 +Cl2
→ 2HCl
70,9 g de Cl2........................2x 36,45g de HCl
X g de Cl2........................... 1000g de HCl
72,9X = 70900
X = 70900/72,9
X= 972 g de gás
Cl2 para produzir 1000 g de HCl.
Vamos complicar
um pouco.
O gás de cozinha (C4H10) reage
com o oxigênio do ar (O2), em uma reação de combustão produzindo
água (H2O) e gás carbônico (CO2). A equação da reação é a
seguinte.
C4H10
+ 9O2 → 5H2O + 4CO2
Veja que nessa
equação, 1 mol de butano produz 4 mols de gás carbônico.
Qual a massa de
CO2 produzida pela queima de 500 g de C4H10?
Vamos às massas
molares primeiro. O butano de tem 4 átomos de carbono (massa atômica 12) e 10
átomos de hidrogênio (massa atômica 1) então a massa molar do gás butano é 4X12
+ 10X1 =58 g/mol. Já o CO2 tem 1 átomo de carbono (massa 12) e 2
átomos de oxigênio (massa 16) então sua massa atômica é 12+ 2X16 = 44.
Vou escrever de
novo a equação para facilitar tua vida.
C4H10
+ 9O2 → 5H2O + 4CO2
Então você vê
que 1 mol de C4H10 produz 4 mols de CO2. Vamos
à regra de 3.
58 g C4H10........................
2X 44 g de CO2
500 g de C4H10...................
X g de CO2
Multiplicando
cruzado temos 58X = 500 x 88
X = 44000/58. Então
X = 758, 62 g de CO2.
Resposta. são produzidos 758,62 g de gás carbônico com 500 g de butano.
Espero que eu
tenha ajudado a você entender pra que serve o cálculo estequiométrico.
quarta-feira, 22 de junho de 2016
Estequiometria e massa molar.
O Cálculo estequiométrico é o cálculo que permite relacionar quantidades de
reagentes e produtos, que participam de uma reação química com o auxílio das equações
químicas correspondentes. Na indústria ou em um laboratório precisamos usar
quantidades certas de reagentes para que não sobrem nem faltem. É preciso
calcular qual a massa de produto será produzido em uma reação sabendo a massa
de reagentes usados.
Segue aqui os links para alguns vídeos explicando sobre estequiometria e
cálculo estequiométrico.
Como não
podemos pesar um átomo isolado com uma balança, nem mesmo contar os átomos um a
um, foi preciso que os químicos encontrassem um valor que indicasse uma determinada
quantidade de átomos ou moléculas que pudessem em fim serem calculadas com uma
balança. Essa unidade é o ‘mol’. Essa unidade de medida de quantidade de
matéria é usada para determinar a quantidade de entidades existentes em uma
determinada massa de uma determinada substância. Um mol equivale a 6,022137 X1023
entidades, esse número feio é a constante de Avogrado, tem esse nome pois o químico italiano
Amadeo Avogrado descobriu que esse número pode ser relacionado com a massa
atômica dos elementos.
Esse cara é o Amadeo Avogrado.
Mas para
facilitar nossa vida vamos arredondar para 6,022X1023. Isso que
dizer que um mol átomos de ferro terá 6,022X1023 átomos
de ferro, 1 mol de moléculas de gás
oxigênio (O2) terá 6,022X1023 moléculas de O2.
Então estendendo para outras coisas, 1 mol de laranjas terá 6,022X1023
laranjas e 1 mol de elefantes terá 6,022X1023 elefantes.
Mas então?
Qual é a relação que isso tem a ver com uma balança?
Acontece
que um mol de um elemento químico pesará em gramas o mesmo que sua massa
atômica. Então um mol de ferro (Fe, massa atômica 55,85) pesará 55,85 gramas,
então sua massa molar será de 55,85 g/mol, e por consequência, em 55,85 gramas
de ferro terá 6,022X1023 átomos de ferro.
Exemplos. 1
Calcule quantos mols existem em 350 g de níquel Ni.
Primeiro
vamos ver na tabela periódica qual é a massa atômica do níquel. ( 58,68).
Então em 1
mol de níquel pesa 58,69 gramas. Agora podemos calcular por regra de 3.
58,68
g........1 mol
350
g.........X mol
Multiplicando
cruzado temos: 58,68X = 350. Então X = 350/ 58,68
Logo 350 g
de níquel equivalem a 5,96 mol.
Mas, e com
substâncias compostas, ou formadas por 2 ou mais átomos?
Bem, nesse
caso temos que somar as massas atômicas de todos os átomos que constituem essa
substância.
Exemplo.
1.Qual a
massa molar do NaCl?
Vejamos.
Massa atômica do sódio é igual a 22,99 e a massa atômica do cloro é 35,45.
Então basta somar as duas massas e teremos 58,44 g/mol.
2. Qual a massa
molar do ácido sulfúrico H2SO4?
Vamos para
a tabela periódica e vejamos as massas atômicas dos três elementos químicos que
constituem esse ácido. H = 1, S=32,07, O = 16. Veja que cada molécula desse
ácido é formada por 2 átomos de H, 1 átomo de S e 4 átomos de O. Então vamos
calcular todas as massas atômicas dos elementos dessa molécula.
2x1 +
1x32,07 + 4x16 = 98,07 g/mol. Então um mol de H2SO4 pesa
98,07 mol. E em 98,07 gramas de H2SO4 teremos 6,022X1023
Então um
mol de O2 pesa 32 g. Pois a massa atômica do elemento oxigênio é 16.
1 mol de Cl2
pesa 70,9 g. Pois a massa atômica do elemento cloro é 35,45.
terça-feira, 21 de junho de 2016
Colesterol. Bom ou ruim.
O colesterol é um composto orgânico produzido pelos organismos dos animais. Sua fórmula molecular é C27H46O. Possui uma cadeia carbônica mista, com 4 ciclos conjugados. Sua função química é álcool.
Mais informações no link abaixo. Link para um dos melhores sites sobre química. A graça da Química.
A Graça da Química. Colesterol
Mais informações no link abaixo. Link para um dos melhores sites sobre química. A graça da Química.
A Graça da Química. Colesterol
segunda-feira, 20 de junho de 2016
Relação entre os bicombustíveis, o desmatamento e a inflação dos alimentos. Fase 1
Estamos inciando uma pesquisa sobre a relação entre biocombustíveis a devastação da amazônia e a fome no mundo.
Eu fiz uma pesquisa rápida no Oráculo Sagrado e postei aqui um link de cada pesquisa. Se vocês quiserem fazer uma pesquisa com outras fontes, os títulos de cada link são as palavras chaves que eu usei. O que está entre parenteses é apenas meu comentário.
Como eu havia dito, vocês precisam apoiar ou derrubar minhas duas hipóteses. 1ª Os biocombustíveis são responsáveis pelo aumento do preço dos alimentos. 2ª Os biocombustíveis não contribuem para a preservação ambiental.
impactos ambientais das usinas de cana-de-açúcar
balanço energético dos biocombustíveis. (artigo acadêmico bem sucinto e com boas informações)
Produção mundial de grãos2015
Produção mundial de grãos 2010
Produção mundial de grãos 2005
Produção mundial de grãos 2000
Produção mundial de soja, de 1987 a 2010
evolução do desmatamento da amazônia (1978 a 2009)
Evolução do desmatamento na Amazônia (2008 a 2014)
Relação entre a soja e o desmatamento
crise mundial de alimentos em 2008 (Artigo científico produzido na UNB, bastante completo, com dados sobre a produção mundial de grão, relação entre o os biocombustíveis e a inflação dos alimentos)
Bons estudos pessoal. conversaremos mais durante a aula.
domingo, 19 de junho de 2016
Plástico verde? Só se for o verde do dinheiro.
Plástico verde? Só se for o verde do dinheiro.
Já faz alguns anos que a palavra da moda é a
sustentabilidade. E para acompanhar essa tendência de mercado, algumas empresas
estão investindo firmemente nisso. Fazendo uma grande campanha de marketing
anunciando seus produtos como ecologicamente corretos. Mas eles são mesmo?
Um exemplo de produto que segue essa tendência de
mercado é o chamado plástico verde, ou plástico derivado da cana-de-açúcar.
Tá mas e aí cara pálida? Como ele é produzido?
Bom, o chamado plástico verde, é produzido a partir
do etanol da cana de açúcar. Para produzir a cana de açúcar são utilizadas
grandes áreas 8.799.150 mil hectares na safra 2013/2014 segundo
a CONAB.
Felizmente o governo proibiu o uso da queimada para limpeza dos canaviais,
reduzindo em grande quantidade a poluição atmosférica nas regiões produtoras
durante o período de safra. Para o plantio da cana, são utilizados adubos
minerais do tipo N-P-K, usados em qualquer atividade agrícola.
1.Tabela 1: Quantidade de
fertilizantes usados na cultura da cana-de-açúcar.
Nutriente
|
Massa
por hectare/ano
|
Nitrogênio
(N)
|
80 a 150
quilos por hectare
|
Fósforo
(P)
|
100 e 150 quilos de P2O5
|
Potássio
(K)
|
80 e 150
quilos de K2O
|
A partir daí
você já pode imaginar que uma grande cadeia produtiva que realiza mineração e
também depende do petróleo, está anterior à porteira da fazenda de cana. Como a
cana não é imune às pragas, uma certa quantidade de agrotóxicos precisa ser
utilizada, e para produzir os agrotóxicos, muitos derivados de petróleo são
utilizados, além de gerar muitos resíduos tóxicos que precisam ser descartados
de maneira adequada.
Bom, você já deve ter começado a perceber que o
plástico verde não brota da Terra. Na produção da cana-de-açúcar é realizado
desde o plantio até a colheita e transporte da cana para a usina um grande
tráfego de máquinas movidas a óleo diesel. Quando a cana chega na usina, ela é moída
e a guarapa é acondicionada em tanques fermentadores para que leveduras
consumam o açúcar produzindo etanol C2H5OH e CO2.
Até aí nenhuma novidade, é o normal de qualquer processo fermentativo,
inclusive para produzir a cerveja que teu pai bebe no domingo.
Após todo o açúcar ser consumido pelas leveduras, o
caldo de cana que fermentou é destilado. Se você lembra o mínimo do primeiro
ano do ensino médio, deve lembrar que para realizar a destilação, é preciso de
uma boa fonte de calor. Felizmente as usinas de álcool queimam o bagaço da
cana, evitando o consumo de derivados do petróleo para essa operação. Mas note que
a destilação foi a única parte do processo até agora que não dependeu dos combustíveis
fosseis. As usinas produzem a maior parte de sua energia queimando bagaço, e a
maior parte da energia elétrica brasileira provem de hidroelétricas.
Após destilado, o etanol é transportado para uma das
usinas que fabricam polietileno a partir do etanol no Brasil. Você já dever ter
imaginado que tudo foi transportado usando veículos elétricos né?...#sqn. Na
usina de polímeros, o etanol C2H5OH é posto reagir com
ácido sulfúrico concentrado, para que a hidroxila seja perdida sob a forma de
água, fazendo com que uma dupla ligação se forme entre os dois átomos de
carbono do etanol produzindo gás eteno, ou etileno, C2H4
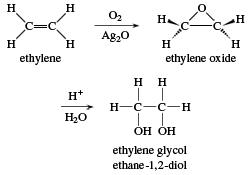
a matéria prima para a produção do plástico verde como demonstrado pela imagem
1. Felizmente além da hidroxila o etanol perde mais um hidrogênio, regenerando o
ácido sulfúrico. Então é só recolher o gás formado e reaproveitar o ácido.
Acontece que essa reação necessita de altas temperaturas para ocorrer em uma
velocidade financeiramente viável. (Dalhe petróleo e energia elétrica).
Imagem 1.Reação de desidratação do etanol.
Daí pra frente o processo de produção do polietileno
é o mesmo usando o etileno proveniente do etanol, ou o etileno proveniente do petróleo
ou do gás natural. A Coca Cola tem usado uma quantidade PET, polietileno
trefitalato, produzido a partir do etanol. E
essa empresa tem feito uma grande campanha de marketing sobre isso. O
PET é o plástico das garrafas de refrigerante e o polietileno é o plástico usado
para a produção da maioria das embalagens plásticas. A reação de polimerização
do etileno está descrita na imagem 2.
Imagem 2. Polimerização do etileno.
Na produção do PET, usa-se em vez do etileno
mostrado acima, etilenoglicol (HOCH2CH2OH), que é posto
para reagir com ácido terefitálico. Como demostrado na imagem 2.
Imagem 3. Processo de produção do PET.
O etilenoglicol usado para produzir as garrafas de
plástico verde de alguns refrigerantes é produzido a partir do etileno
produzido com etanol da cana-de-açúcar. A imagem 4 explica como ele é
produzido. A partir daí você já pode perceber que existe mais uma etapa no
processo que depende de mais energia para ser executado
Imagem 4. Produção do etilenoglicol
Você já deve estar com vontade de me mandar catar
minhocas no asfalto quente com uma picareta de borracha. Então eu respondo por
que fiz este artigo criticando o uso de fontes renováveis na produção de
plástico.
Apesar de se usar uma fonte renovável, que é a
cana-de açúcar, muito lixo continua sendo produzido, e o plástico não é
biodegradável por ser chamado de verde. Ele demora o mesmo tempo que o plástico
derivado do petróleo para se degradar.
Então Antônio, o que você propõe?
Eu proponho a mesma coisa que se propunha quando eu
estudava no ensino fundamental. Reduzir a produção de lixo. Não adianta apenas
incentivar a reciclagem, pois boa parte do lixo não pode ser reciclado. É preciso rever
nossos hábitos de consumo. Estamos levando para casa cada vez mais embalagens e
menos conteúdo. E ironicamente nessas embalagens está escrito que a empresa que
produziu aquele produto pensa no meio ambiente. Só se for para encher o caixa.
Referências
1.CONAB Companhia Nacional de Abastecimento. Levantamento
de safra 2013/2014 Disponível em http://www.conab.gov.br/OlalaCMS/uploads/arquivos/13_08_08_09_39_29_boletim_cana_portugues_-_abril_2013_1o_lev.pdf
Acessado em 19/06/2016
2. SOLOMONS, T.W.Graham; FRYHLE,Craig B. Química Orgânica volume 1. 10 edição.
Rio de Janeiro, 2012 LTC- Livros Técnicos e Científicos Editora Ltda.
Créditos das imagens
1. http://alunosonline.uol.com.br/quimica/reacoes-desidratacao-alcoois.html
2. http://wmnett.com.br/quimica/o-que-sao-polimeros/
3 http://alunosonline.uol.com.br/quimica/pet-um-poliester-importante.html
4. http://global.britannica.com/science/ethylene-glycol
Metais que explodem a água. Metais alcalinos
Algumas pessoas realmente detestam tomar banho, as vezes o teu bichinho de estimação também
reage violentamente quando obrigado a isso. Na tabela periódica existe uma família que também fica muito brava quando obrigada a tomar banho. Essa família é a família 1A ou grupo dos metais alcalinos. Eles têm por característica o maior raio atômico de cada período, e apenas um elétron na última camada, e por isso eles perdem esse elétron com muita facilidade para o oxigênio do ar, ou
para a água. Isso faz com que eles devam ser conservados imersos em querosene ou outro hidrocarboneto para não reagirem. O grande raio atômico também faz com que eles sejam moles e leves, além de terem um baixo ponto de fusão.
O nome alcalino vem do árabe álcali, que significa cinza de árvores. As cinzas de árvores ao serem misturadas com a água apresentam boas concentrações de hidróxido de potássio KOH, mesma
substância formada ao reagir potássio metálico com água.
O elementos da família do Cascão, digo, família do lítio, são muito importantes. O Lítio por ser muito leve e ter um potencial padrão muito negativo, -3,05V ,é usado nas baterias de equipamentos eletrônicos. O sódio e o potássio são nutrientes muito importantes para o bom funcionamento dos organismos vivos, além de uma grande aplicação industrial.
As equações das reações envolvendo um metal alcalino e água são genericamente descritas assim 2M + 2H2O → 2MOH + H2. H2 é o gás hidrogênio que é inflamável.
Ao reagir um metal alcalinocom o oxigênio do ar a reação é 2M + O2 → M2O.
O frâncio Fr é um metal radioativo que decai em 22 minutos. Portanto ele não é encontrado na natureza. É produzido nas usinas nucleares ou durante explosões atômicas.
Agora veja no vídeo o que acontece quando colocamos um pedaço de cada um desses metais na água. O vídeo está em inglês, mas dá pra entender quando ele diz o nome de cada elemento químico. Ordem lítio, sódio, potássio, rubídio e césio. Por quê? Por que além de aumentar a eletropositividade nessa ordem, ao descer no grupo, a densidade aumenta, fazendo com que o metal afunde e toda a sua área entre em contado com a água.
Atkins,
P. Jones, L. Princípios de Química Questionando a vida moderna e o meio
ambiente. Porto Alegre: Bookman 2001.
Referências :
Assinar:
Postagens (Atom)